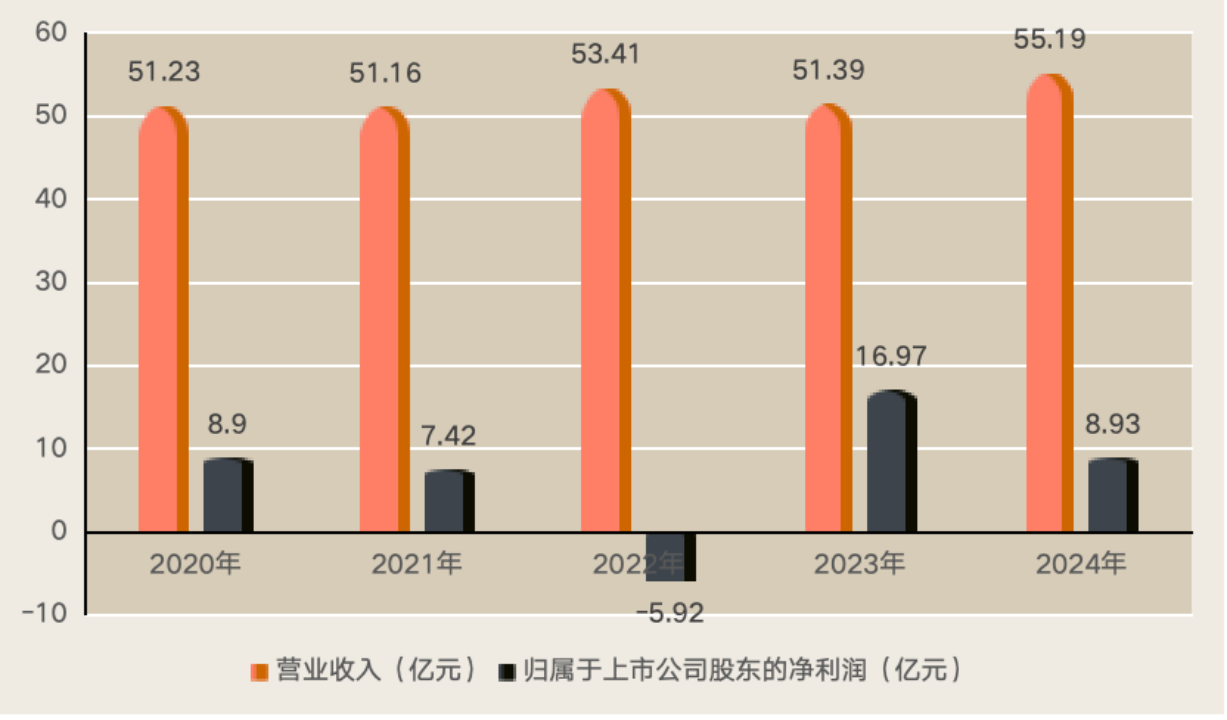
張文宏:mRNA疫苗技術落地預示可能會帶來生物醫藥領域的巨變
2023年10月2日下午5點45分,2023年盧保生理學或醫學獎花落卡塔林·卡利高(Katalin Karikó)和德魯·維斯曼(Drew Weissman),他們因為研發的mRNA技術,推動COVID-19 的 mRNA 疫苗發展而獲獎。

如果沒有新冠疫情大暴發,該技術在人類的應用可能還要等待更久時間。因為這個mRNA疫苗技術原本一直聚焦在腫瘤的治療性疫苗研發,該技術在短期內就能研發各種不同於正常人體細胞的腫瘤細胞新抗原,進而誘發強烈的獲得性免疫反應以期來治療腫瘤。
讓我們一起通過這篇文章瞭解新冠mRNA疫苗的研發始末,並瞭解卡塔林·卡利高和德魯·維斯曼在此中的卓越貢獻!
1
一、mRNA技術起源於科學家對人類基因的深入認知
1944年,洛克菲勒研究院的艾菲利等提出脫氧核糖核酸(DNA)是遺傳的物質基礎。1953年,沃森和克里克發現了DNA雙螺旋的結構,開啟了分子生物學時代,使遺傳的研究深入到分子層次,「生命之謎」被打開,使人們清楚地瞭解遺傳信息的構成和傳遞的途徑。

艾菲利提出DNA是遺傳的物質基礎
1961年,在加州理工學院的一個實驗室,科學家首次成功提取到mRNA。之後對其功能和生物學行為進行了充分的研究。科學界發現,在DNA和蛋白質之間有個「中間人」,負責傳遞信息,mRNA正是這個「中間人」。

沃森和克里克發現了DNA雙螺旋的結構
mRNA(Messenger RNA),又稱為信使RNA,是由DNA的一條鏈作為模板轉錄而來的,攜帶遺傳信息的能指導蛋白質合成的一類單鏈RNA。通俗來講,mRNA複製了細胞核中雙鏈DNA的一條鏈的遺傳信息,隨即離開細胞核在細胞質中生成蛋白質。在細胞質中,核糖體沿著mRNA移動,讀取其堿基序列,並翻譯成其相應的氨基酸,最終形成蛋白質。
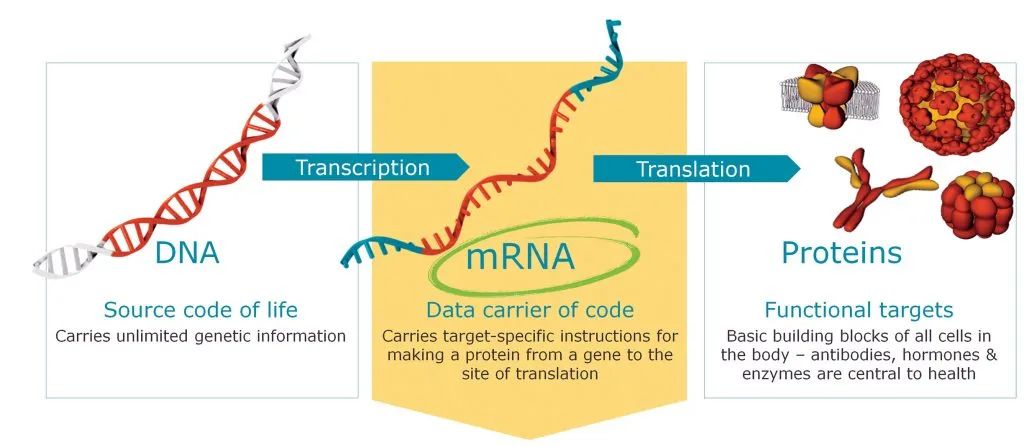
mRNA是由DNA的一條鏈作為模板轉錄而來,攜帶遺傳信息的能指導蛋白質合成
1990年,威斯康星大學Wolff等才首次報導肌內注射mRNA到小鼠骨骼肌里,可以表達相應蛋白質並產生免疫反應。這揭示了mRNA技術用於疫苗研究的可能性。2年後,又有研究者將編碼激素的mRNA,直接注射至小鼠大腦中,發現有緩解尿崩症的作用。這說明mRNA具備成為治療性藥物的潛力。
mRNA疫苗的原理是是將編碼疾病特異性抗原的mRNA引入體內,利用宿主細胞的蛋白質合成機制產生抗原,從而觸發免疫應答,從而達到預防疾病作用。如果將人體比作一台機器,那麼數百萬種微小的蛋白質便是維持機器運行的零部件,而mRNA則是製造零部件的總指揮。
也就是說mRNA序列注射到人體後,跳過體外合成蛋白質的過程,直接在人體細胞內生產病原體免疫表位的蛋白,對免疫系統進行了「戰前演習」,誘導識別病毒蛋白,從而產生對特定病原體的免疫記憶。當真正病原體進入人體時,免疫細胞如同訓練有素的軍人,快速識別病原體對其發動精準攻擊。
2
二、mRNA技術用於疫苗研發的優勢在哪裡?
mRNA 疫苗技術路線相比更傳統疫苗具有三個重要的優勢:快速、安全和高效。
1)mRNA疫苗最為顯而易見的優勢就是快速。
和其他類別的疫苗相比,mRNA疫苗最大的優勢在於一旦掌握病原體的基因序列,就可以很快研製出mRNA疫苗。mRNA疫苗技術因其在設計和構建上的快速性和對病毒變異的高度應變性,以及高效的通用性全合成生產工藝平台, 易於標準化生產等技術優勢決定了其生產環節及研發週期短,工藝相對簡單,疫苗能夠迅速量產。
新冠病毒基因序列發佈42天后,科學家就設計出了第一款mRNA疫苗。同時如果病毒變異導致疫苗失效,mRNA技術也可以在很短的時間內(1-2個月),改變mRNA序列,推出升級版的疫苗,以及時應對病毒變異。
可以說,單憑快速這個技術優勢,就滿足了傳染病暴發時快速研發和大規模、低成本、靈活性生產應急性疫苗的技術要求,也是今後人類對抗新的傳染病暴發的有利手段。
2)mRNA的第二個優勢是安全。為什麼這麼說?
(1)和傳統疫苗相比,從生產mRNA疫苗的過程來看,因為不需要大量培育活病毒,從而避免了疫苗生產過程中發生活病毒泄露的風險。當然,這個風險是可以通過嚴格的GMP制度來控制預防的。
(2)也是和傳統疫苗相比,mRNA疫苗生產不會涉及感染性元素,因此不會發生由於類似脊髓灰質炎疫苗曾經發生過的種種感染風險。同樣,嚴格的GMP制度也能保證,或者說最大程度上降低這種風險。
(3)對於各類核酸疫苗或者核酸藥物而言,mRNA片段理論上不會進入細胞核,因此也不存在穩定整合到宿主細胞基因組的風險,也就是說mRNA疫苗不會改變人體細胞中的DNA遺傳物質;相反,mRNA只是在人體細胞漿內短暫停留,一旦生產出蛋白質,疫苗的RNA鏈就會被降解。
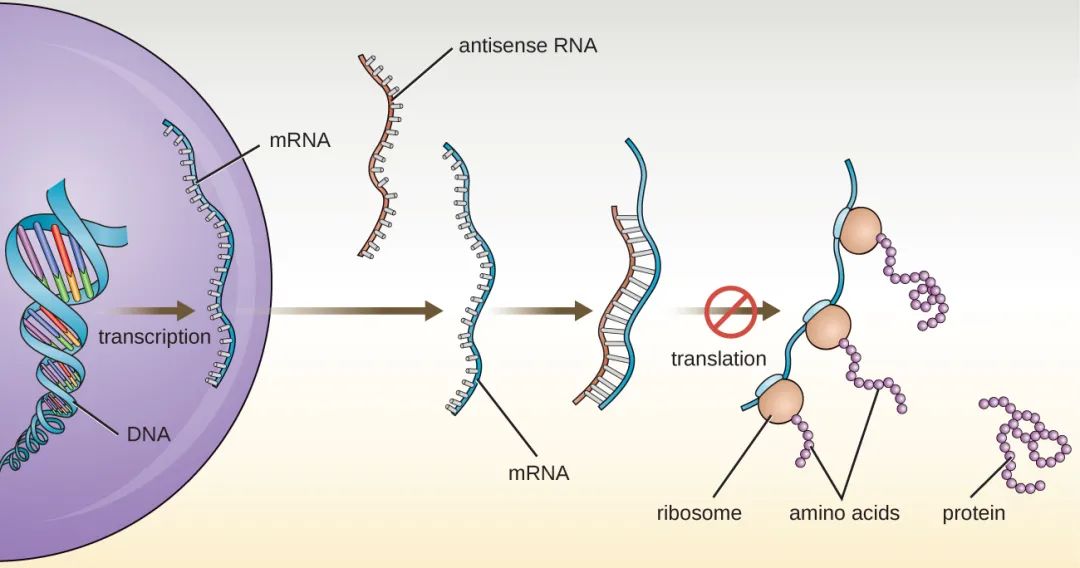
mRNA片段不進入細胞核,沒有穩定整合到宿主細胞基因組的風險
(4)與傳統滅活疫苗相比,mRNA疫苗通常不需要額外的免疫佐劑,因此也就避免了佐劑造成不良反應的風險。
當然,上述關於安全性的優勢還有待於大規模的臨床運用中得到驗證,作為一種全新機制的疫苗,完善的上市後安全性監測必不可少。
3)mRNA疫苗的第三個優勢是高效。
傳統的滅活疫苗通過添加佐劑會影響體液免疫並增強抗體反應,但通常不能誘導細胞免疫。相比之下,基於基因的疫苗載體可以刺激體液免疫和細胞免疫,從而對傳染原提供更大的選擇壓力。此外,mRNA疫苗只要設計核酸並加以合成就可以,無需在體外表達蛋白,因此有條件只做針對數個病毒的組合疫苗,只要把靶基因串聯在一起就可能成功研製出組合疫苗,做到一苗多用,注射一種疫苗,可以同時預防多重疾病。比如將流感和新冠疫苗做在一起,多重病毒亞型做在一起,既方便又高效。
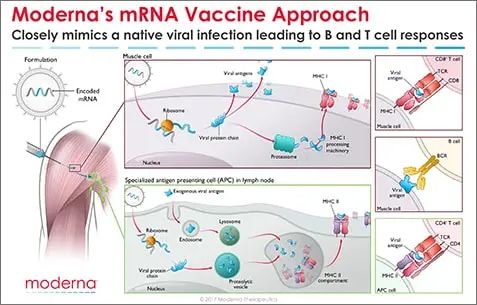
mRNA疫苗能誘導有效的MHC I類限制性CD8+以及MHC II類限制性CD4+T細胞反應
3
三、mRNA 技術突破了人類免疫系統對外來核酸的識別和消除
雖然,mRNA疫苗從理論上來看,具有這麼多的優勢,但為何直到新冠疫情暴發前,卻一直沒有任何一款mRNA疫苗問世呢?我們接著往下說。
長期以來,mRNA 作為疫苗的研究,因為受到分子的不穩定性、免疫刺激不足和mRNA 遞送時的低表達水平的阻礙而進展緩慢。幸好科學家們沒有因此放棄,經過20多年的時間,將上述難題逐一攻克了。
對於mRNA分子的不穩定性,這個問題是最早被搞掂的。科學家們認識到,RNA之所以不穩定,是因為我們的環境中存在大量可以分解RNA的酶RNase,只要防止接觸RNase,或者通過試劑消除容器中的RNase,RNA 反而是一種相對穩定的物質。並且可以以凍干形式在環境溫度下長期儲存,極大地促進了分配和儲存 。
第二個難題是不能產生足夠的免疫反應,這個問題是最致命的,如果解決不好,mRNA疫苗的研發就會前功盡棄。
科學家們將最初在實驗室設計合成得到的mRNA疫苗進行動物實驗時,發現這些mRNA在小鼠身上不能產生任何設想中的免疫反應,也就是說疫苗沒有發揮作用。這是什麼原因呢?經過反復深入的研究,科學家們才發現原來小鼠免疫系統將mRNA當做了外來物,直接發起免疫反應將mRNA給清理掉。這對於之前信心滿滿的科學家是當頭一棒。
來自匈牙利生物化學家賓夕法尼亞大學的卡塔林·卡利高(Katalin Karikó)致力於開發利用mRNA進行治療的方法。她與免疫學家德魯·維斯曼(Drew Weissman)就這個難題開展了卓有成效的合作,找到mRNA的「致命弱點」。並通過mRNA修飾技術,成功解決了這一難題。
他們發現哺乳動物細胞RNA中的堿基經常被化學修飾,而在試管內轉錄的mRNA不是。他們想知道是否缺乏改變的堿基在試管內轉錄的RNA可以解釋不必要的炎症反應。為了研究這一點,他們產生了不同的mRNA變體,每種變體的堿基都有獨特的化學變化,然後將它們傳遞給樹突細胞。結果是驚人的:當mRNA中包含堿基修飾時,炎症反應幾乎消失。
他們證明,mRNA之所以能引起宿主的免疫反應,關鍵在於一種叫做尿嘧啶的核苷酸。如果能修改其核苷部分,創造一個假尿嘧啶代替原來成分,就能大大降低樹突狀細胞識別出該mRNA的可能性,從而躲避免疫應答。這是我們對細胞如何識別不同形式的mRNA並對其做出反應的理解的範式轉變。卡利高和維斯曼立即意識到他們的發現對使用mRNA作為治療手段具有深遠的意義。
他們的研究發表於2005年,比新冠疫苗的研發足足早了15年。這一難題的解決也就是卡利高和維斯曼此次榮獲盧保生理學或醫學獎的原因。

卡利高和維斯曼通過mRNA修飾技術解決了mRNA被宿主固有免疫識別和清除的難題
此外,另一個難題也有待解決。理論上mRNA無所不能,但很難進入臨床研究,很大一個原因是mRNA進入人體非常低效,也就是缺乏一種有效的載體幫助mRNA進入細胞。2015年科學家將mRNA製成微小脂肪粒,稱為脂質納米顆粒(Lipid Nanoparticles, LNPs),以提高穩定性並使其更容易進入細胞,顯著改善了mRNA疫苗的信息傳遞效率。
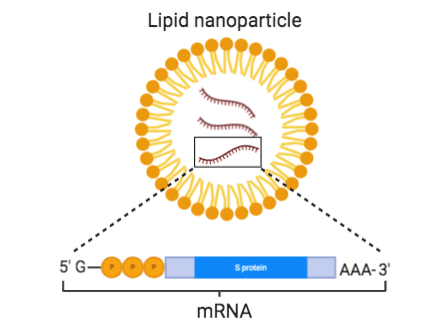
LNP顯著改善了mRNA疫苗的傳遞效率
脂質納米顆粒具有較好的生物相容性和生物降解性。納米藥物最顯著的特性是高表面積體積比,這實現了高效的藥物包裝。封裝的藥物受到保護,免於降解和免疫清除,並且由於有效的藥物包裝,可以大大降低給藥劑量。當然,LNP還是有一定的反應原性,可能會造成接種者大概100萬分之幾的比例出現嚴重的過敏症狀,技術上有進一步改進的空間。
至此,mRNA疫苗卡脖子的難題被逐一突破,全新的mRNA疫苗呼之慾出。
4
四、為什麼是新冠大暴發才促成mRNA技術的落地?
2020年新冠疫情暴發,mRNA疫苗得以一戰成名。其實在新冠疫苗之前,大部分關於mRNA疫苗的早期工作都集中在癌症方面。癌症疫苗是治療性的,而不是預防性的,旨在針對腫瘤細胞優先表達的腫瘤相關抗原,因此,刺激細胞介導的免疫反應,能夠減少腫瘤負擔。
目前針對癌症領域的mRNA疫苗涉及的臨床試驗適應症包括了乳腺癌、非小細胞肺癌、黑色素瘤、多發性骨髓瘤等,其中也有多項臨床試驗已經進入了Ⅱ期臨床研究階段。
同時,目前在針對感染病領域mRNA疫苗開展的臨床研究有很多,其中適應症包括了狂犬病、人偏肺病毒、寨卡病毒、鉅細胞病毒和HIV等,其中針對HIV的多項臨床試驗已經進入了Ⅱ期臨床研究階段。
除了在癌症和傳染病方面,最近的動物研究結果表明,RNA疫苗還有可能用於預防或治療過敏和自身免疫性疾病。
如果沒有新冠疫情發生,上述關於mRNA疫苗的研究正在不急不慢地進行中,原本估計要出現獲批的RNA疫苗大概至少還需要5到7年的時間。
不過在新冠疫情中,前所未有的合作環境和政府投資徹底改變了一切,幾個月內就通過有效性數據和大規模應用為疫苗提供了概念性驗證。政府支持幫助製造商在風險中擴大規模,同時獲取了第一批有效性數據。
2020年7月,III期臨床試驗開始。當III期臨床研究完成,疫苗準備提交監管部門批準時,企業就已經開始大規模生產儲備。
2020年11月16日,Moderna公佈了III期臨床數據,30000名接種者中,疫苗有效率94.5%,重症保護力100%。11 月 9 日,BioNTech的III 期臨床數據公佈,mRNA 疫苗有效率超過 90%。
2020年12月,兩家公司的新冠mRNA疫苗先後在多國獲批上市。人類也隨之拉開了大規模疫苗接種的序幕。
美國國家過敏和傳染病研究所的安東尼・福奇和約翰・馬史高拿曾經在《自然免疫學評論》雜誌上寫道:mRNA有可能成為一個快速靈活的疫苗平台。由基因序列開始,幾週內就可以生產出mRNA疫苗。
2020年新冠疫情暴發,mRNA技術剛好準備就緒,成就了一次天時地利的歷史巧合。經過約40年的上下求索後,mRNA技術終於迎來全新篇章。從新冠疫苗起步,到癌症治療,未來mRNA技術或許能夠逐步涉足更多疾病領域。

張文宏教授點評
mRNA疫苗技術落地是人類文明史上的又一次「盜火」,預示可能會帶來生物醫藥領域的巨變
人類識別外來病原體的核酸並誘導強烈的炎症反應,通過炎症反應消除病原體是人類進化中形成的保護機制,可以有效識別各種蛋白和核酸。天然免疫細胞可以識別DNA或者RNA病毒的核酸, 進而誘發強烈的炎症反應,同時對病毒抗原進行呈遞,誘導獲得性免疫,達到消除病原體的目的。這是人類在自然界生存數百萬年的免疫力密碼,但mRNA 疫苗注射後也會像病毒一樣,被人類的免疫系統識別,誘發炎症反應,最終被迅速降解,就不能繼續表達疫苗靶蛋白,起到疫苗的作用了。mRNA疫苗技術的落地正好是繞過了人類數百萬年形成的核酸識別與炎症反應,讓mRNA疫苗實現在體內靶向分子的表達,這一技術落地是人類科學的又一次底層技術突破,會帶來我們難以預計的生物醫藥領域巨變。
從疫苗的發展史來看,就時間線上而言,減毒活疫苗和滅活疫苗最早來到科學舞台上,是科學家針模擬人類感染病原體後產生免疫力的過程,來完成了一次與自然感染接近的過程,進而獲得了免疫力,比如天花病毒疫苗、水痘病毒疫苗、麻疹病毒疫苗都是屬於這一類,這些疫苗在人類歷史上消除傳染病流行立下了不滅的功勳。隨後是重組蛋白疫苗等組分疫苗問世,這一代的疫苗是通過模擬病毒一些重要蛋白而製作的靶向疫苗,人體針對這些病毒組分產生抗體和免疫反應,起到建立免疫力的作用,針對特定的組分產生的免疫力會更強,像乙肝疫苗就是這一類疫苗,目前我國2000年後出生的群體幾乎人人接種了乙肝疫苗,因此2000年以後出生的人口中,幾乎很少有人感染乙肝病毒了。mRNA屬於核酸疫苗,新冠疫情中首次用於人類對抗疾病,系通過直接注射mRNA在體內表達特異性蛋白來保持持續的免疫應答,建立很強的免疫力。由於在疫苗的製造工藝上不需要再進行蛋白的表達和純化,只要合成基因就可以了,對疫苗的製造工藝而言是一次極大的技術突破,用於應對新冠這樣的突發傳染病,優勢非常明顯。但更為重要的是這類技術的臨床應用從此打開了一個新的天地。
人類文明從掌握用火的技術開始,自此人類的發展日新月異,從沃森發現DNA雙螺旋結構,繼而明白了基因複製和翻譯功能蛋白的秘密,直至這次通過mRNA 技術用於疫苗的研發和應用,以及應對大流行的成功,標誌著人類掌握了直接輸注核酸在體內表達所需要的疫苗成分或者其他疾病治療所需要的蛋白組分,對於腫瘤性疾病、遺傳性疾病、免疫性疾病,將帶來極大的前景。
編輯 陳豔婷