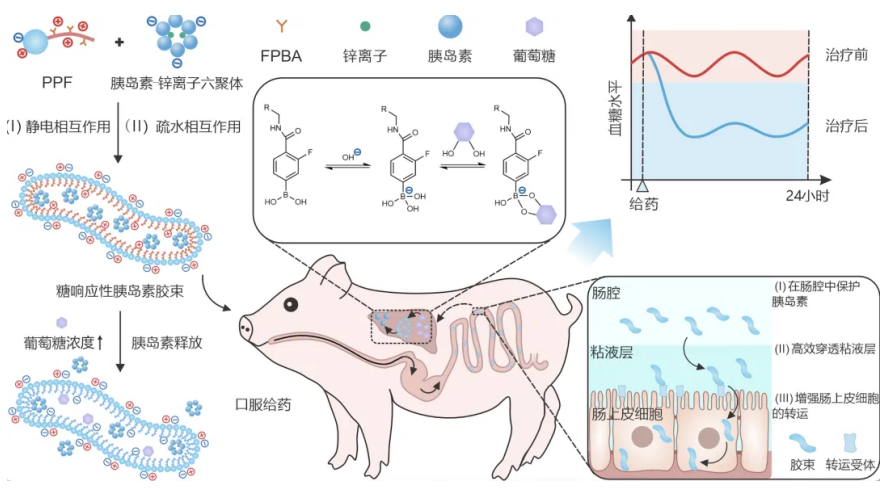
動物模型血糖被控長達一天,浙大團隊製備口服胰島素製劑,小鼠連續給藥7天未出現低血糖
「當看到口服胰島素能夠降血糖那一刻,看到膠束聚集於肝臟那一刻,看到小鼠血糖鉗夾試驗和糖耐量試驗驗證了體內糖響應那一刻,我確信我們取得了比較激動的進展。」浙江大學百人研究員王金強表示。
他繼續說道:「通過口服胰島素,讓實驗動物模型能夠遠離低血糖狀態,並且能讓動物模型在 90% 的時間里將血糖控制在正常範圍內,我至今都覺得挺興奮。」

近日,他和所在團隊打造出一款口服胰島素製劑,能夠進一步減輕糖尿病患者對於注射胰島素的恐懼,也能減輕該類患者對於低血糖和注射疼痛的恐懼。
與此同時,這款新型製劑能潛在進一步提升糖尿病患者的血糖控制效果,並能提升「糖友」們的生活質量。此外,該製劑也可用於其他多肽或蛋白類藥物的口服遞送。

人體究竟如何有效利用胰島素實現血糖控制?
王金強表示,自己從 2016 年開始在美國北卡羅來納大學教堂山分校及加州大學洛杉磯分校,跟隨當時在那裡工作的顧臻教授從事博士後研究。
自那時起,王金強就聚焦於糖響應胰島素及其遞釋系統的研發。
據他介紹,人體體內的胰島素之所以能安全地控制血糖,其中一個原因是因為人體胰島素的分泌是隨著血糖的波動而同步波動的。
也就是說,糖響應胰島素——是解決現有普通胰島素製劑易於低血糖和血糖控制不佳等問題的重要途徑。
2020 年,顧臻回國加入浙江大學擔任講席教授和該校藥學院院長,王金強也隨之加入浙江大學擔任百人研究員。
自顧臻回國成立團隊至今,該課題組已經研發出多種基於不同糖響應機制的創新胰島素遞釋系統,既涵蓋了微針製劑和注射製劑,並證明它們存在良好的體外和體內的糖響應胰島素釋放能力。
在此基礎上,如何讓糖響應胰島素遞釋系統更好地發揮控制高血糖和降低低血糖風險的作用,是王金強一直在思考的問題。
王金強一直很好奇的是:人體到底是如何有效利用胰島素進行控制血糖的?
他表示,自己對於人體如何既安全又高效地利用胰島素的好奇心,並沒有因為成功構建了糖響應胰島素而終止。相反,他對於其背後工作原理的好奇心一直在逐日增加。
搜索血糖相關數據時可以發現,對於健康人的血糖來說,它被人體控制得十分完美,幾乎總是被控制在正常範圍內。
儘管王金強和同事做了很多努力,也證明了多種糖響應機制,但是讓注射的胰島素達到像健康人體一樣的水平去控制血糖是他們的終極目標。
事實上,人體存在多種調控手段去控製糖代謝,包括胰高血糖素、生長激素、腎上腺素、胰島素等等。
而通過進一步的調研他們發現:人體在分泌胰島素的時候,會首先進入肝臟。這時,高濃度的胰島素可以有效地抑制肝臟的糖原分解,並能促進肝糖原的合成。
然後,胰島素會再次進入全身,進而靶向脂肪組織和肌肉組織。胰島素在經過肝臟的時候,大約 50% 的胰島素會留在肝臟,從而能夠降低周體的胰島素暴露量,進而只讓適量的胰島素去刺激脂肪細胞和肌肉細胞攝取葡萄糖。
也就是說,人體內的胰島素存在一個肝臟到周體的胰島素濃度梯度。
這讓團隊意識到,胰島素就像是一個開關,能讓肝臟組織像一個葡萄糖的蓄水池一樣工作。即它在餐後把糖存起來,然後在空腹時把糖釋放出來。
而人體中的所有肌肉細胞和脂肪細胞,只會攝取葡萄糖,基本不釋放葡萄糖。
該團隊的前期研究結果表明:只要能夠構建體內響應的糖響應胰島素,就能在人體出現低血糖時減少胰島素的釋放量,從而降低對於肌肉組織和脂肪組織的刺激作用,進而減緩低血糖發生的概率和程度。
那麼,要想進一步地完善胰島素的血糖控制水平,或許可以通過仿生手段讓肝臟成為人體胰島素製劑的主要靶點。
基於此,他們希望驗證這樣一個問題:即肝臟靶向的胰島素遞釋系統是否真如預料的一樣,可以減緩低血糖的發生?
 (來源:資料圖)
(來源:資料圖)
實現 10 倍的促進血糖代謝作用
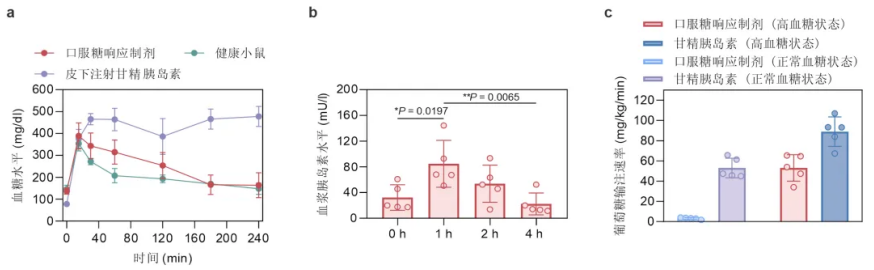
為此,王金強等人設計、製備並驗證了口服糖響應胰島素。
他表示:「這個口服胰島素納米顆粒的形狀是彎彎的棒狀。載體疏水嵌段利用其疏水性和正電性能夠保護胰島素遠離酶,減緩其在胃腸道中的酶解速率,從而留出足夠的時間穿透粘液並被腸道吸收,使得生物利用度能達到 18.9%。」
其發現當這個遞釋系統被腸道吸收後,可以在肝臟內建立胰島素儲庫。被釋放出來的胰島素會首先進入肝臟組織,然後再進入全身從而實現「形成從肝臟到全身由高到低的胰島素濃度梯度」的目的。
當血糖升高時,儲庫中的胰島素被快速釋放,並且同樣會首先經過肝臟組織,與肝臟細胞表面的胰島素受體結合,而部分胰島素也會被肝臟代謝,剩餘部分進入全身。
一開始,王金強和同事打算做一些能夠懸浮穩定的納米糖響應胰島素製劑,以用於該團隊的另外一個課題。
後續實驗也證明這些製劑在體內外具有糖響應釋放能力。也就是說,納米尺寸並不影響其糖響應釋放胰島素的能力。
「不過,我們在選擇親水段的時候藏了個心眼,我們用了一個具備穿透粘液層、並且能夠被腸道高效吸收的親水聚合物,想著萬一以後或許還能用於口服胰島素的遞送。」王金強說。
「當我看到這個製劑的棒狀膠束形狀時,我心想這確實有點意思。因為我們以前做過棒狀膠束相關課題,瞭解到棒狀膠束與等流體力學體積的球狀膠束相比,它的穿透能力和擴散能力的確更強。」他補充說。
因此,他讓組里的博士研究生季康凡嘗試研究一下這個製劑在 1 型糖尿病小鼠上是否具有口服降糖效果。
 (來源:資料圖)
(來源:資料圖)嘗試之後發現效果確實不錯:即這個膠束能夠在胃腸道被吸收,同時還能進入血液。
隨後,他們在細胞實驗、體外粘液滲透實驗和體內實驗方面進行進一步的深入研究,發現了膠束促進胰島素的腸道吸收的原因(保護作用和促滲透作用)。
此外,通過觀察肝臟切片,他們發現這個膠束在腸道吸收後可以進入肝臟,從而能夠形成一個儲庫,進而將胰島素慢慢釋放出來。
最令人興奮的是,在糖耐量試驗中,小鼠血液中的胰島素濃度隨著血糖的升高而升高,這證明本次體系確實在小鼠體內發揮了作用。
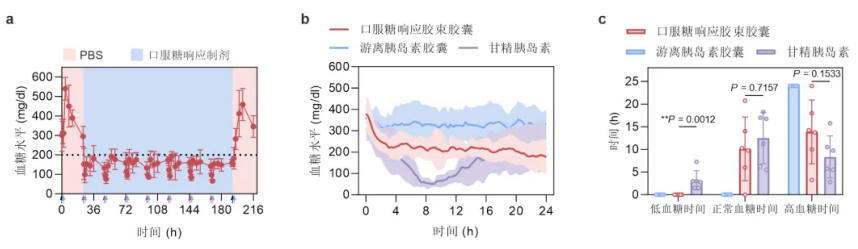
具體來說,該團隊將遞釋系統在自發 1 型糖尿病模型即在 NOD(non-obese diabetic)小鼠中,連續喂藥 7 天,期間基本沒有發生低血糖,並且 90% 左右的時間小鼠血糖維持在正常範圍內。
這個結果不僅非常出乎意料,還意味著肝臟靶向對於補充糖響應性能具有重要作用。
隨後,論文一稿返修之後,他們按照審稿人的意思,做了難度較高的小鼠血糖鉗夾試驗。
王金強說:「這裏要感謝論文第一作者季康凡同學。他花了整整一個月時間,DIY 出來一套小鼠血糖鉗夾試驗裝置。」
最後的實驗結果證明口服糖響應胰島素製劑能夠在高糖條件下,展現出高於正常血糖條件下 10 倍的促進血糖代謝作用。
據季康凡回憶:「在連續 18 小時的糖尿病小鼠血糖監測實驗中,第一次驗證了我們的膠束製劑能夠實現口服長效的血糖控製作用。」
那一天做完實驗已經是淩晨,季康凡向王金強彙報了這個結果。當夜,王金強迅速回覆消息並規劃了下一步的工作方向。
 (來源:資料圖)
(來源:資料圖)季康凡是第一作者,浙江大學百人研究員王金強和浙江大學顧臻教授擔任共同通訊作者。
圖 | 相關論文(來源:Nature Nanotechnology)
如前所述,他們在小鼠葡萄糖鉗夾試驗中,發現口服胰島素製劑能夠產生糖濃度依賴的血糖代謝效果。
也就是說,血糖越高,口服製劑的降糖能力越強,這意味著口服製劑能夠產生體內糖響應效果,進而對於提升餐後血糖控制具有重要價值。
「同時,這個體系也告訴我們肝臟靶向和糖響應胰島素的聯合應用,將產生非常積極和樂觀的結果。因此,我們也在努力地構建類似系統。」王金強表示。
目前,他們正在進一步優化載體結構,希望能夠加速成果臨床轉化的步伐。
王金強補充稱:「最近有媒體報導中國科學家利用轉分化的胰島細胞進行了 1 型糖尿病的治療,取得了非常大的成功。」
很多人也問他,同行的這一研究成果是否意味著以後所有糖尿病人都不需要使用胰島素了?
對此,他表示:「首先,我覺得同行的這一工作意義重大,也希望從此以後所有糖尿病人都可以不再使用胰島素。」
但是,所有療法都有其適應的人群,同時要考慮風險、費用、後期護理等因素。因此,胰島素在將來一段時間內,將依然是大部分糖尿病人的主要治療手段。
這就像腫瘤中的細胞治療、免疫治療的意義非常重大,但是依然沒有影響靶向藥和化療藥物在當下以及未來的重要價值。
總的來說,通過本次研究他們已經獲悉糖響應和肝靶向,對於胰島素的安全高效控糖都非常重要。
因此,他們擬在下一步研究中,繼續提升口服胰島素製劑的生物安全性、製備的簡易性以及生物利用度,推動其臨床轉化。
此外,王金強和顧臻團隊也在考慮能否製備一款可皮下注射的肝靶向糖響應胰島素製劑,目前相關工作也正在進行中。

參考資料:
1.Ji, K., Wei, X., Kahkoska, A.R.et al.An orally administered glucose-responsive polymeric complex for high-efficiency and safe delivery of insulin in mice and pigs. Nat. Nanotechnol. (2024). https://doi.org/10.1038/s41565-024-01764-5
運營/排版:何晨龍