為癲癇治療提供新策略,科學家揭示前額葉與紋狀體連接在癲癇中的關鍵作用
近日,永展醫藥卓敏教授團隊通過研究前額葉扣帶回(ACC,anterior cingulate cortex)到紋狀體興奮性單突觸投射的功能,揭示了海人澡酸(KA,kainate)受體在癲癇之後,會選擇性地在大腦投射通路上出現上調。
KA 受體在大腦裡面,既參加正常的生理功能,也參與病理作用,尤其是癲癇。過度的激活該受體會導致大腦中的神經元,尤其是中間神經元的壞死。
該團隊早期的工作發現,KA 受體還能參與痛覺的傳遞,但是在中樞神經系統中,該受體的具體生理以及病理功能還不清楚。
這項工作中,該課題組發現了上調的突觸和分子機制,這對於未來開發新的藥物以及幫助改善治療癲癇病人的臨床方案,具有重要的意義。
比如,在這項工作中發現的 AC1 以及 KA 受體的抑製劑,都可以用來減輕癲癇的症狀,為在臨床上治療癲癇提供了新的大腦網絡機制。
近年來,由於光遺傳技術以及神經生物學方法的不斷革新,使得研究人員可以選擇性地研究 ACC 到不同腦區的投射在相關的大腦網絡不同功能中的重要作用。
因為 ACC 在痛覺和情緒中的重要作用,這兩個核團之間的聯繫解釋了癲癇的病人經常會有中樞痛以及情緒的變異。
該團隊多年來一直從事 ACC 相關的大腦功能在正常生理和病理下的作用,尤其是慢性痛,學習記憶和焦慮。
西安交通大學李旭輝副教授是第一作者,卓敏擔任通訊作者。
圖丨相關論文(來源:Advanced Science)
要知道,ACC 是情緒反應和感官知覺的關鍵皮質區域。然而,對行政協調會產出的具體作用知之甚少。
在本研究中,研究團隊揭示了突觸傳遞的特點以及 ACC 與紋狀體聯繫的作用,並探討了 ACC 到紋狀體的投射在癲癇病理情況下可能出現的變化。
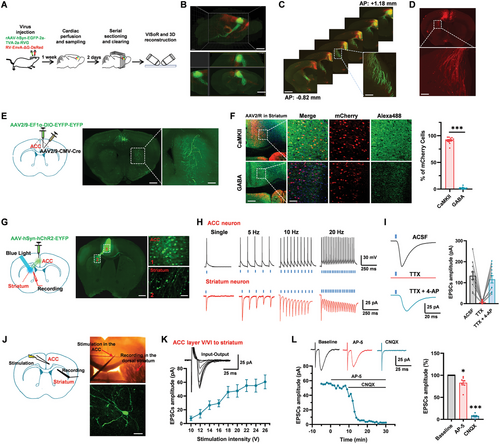 圖丨背側紋狀體神經元接受來自 ACC 的穀氨酸能直接下行投射(來源:Advanced Science)
圖丨背側紋狀體神經元接受來自 ACC 的穀氨酸能直接下行投射(來源:Advanced Science)研究人員首先採用了病毒追蹤技術,並結合 VISoR 成像技術和 3D 重建等前沿技術手段,發現了 ACC 到紋狀體之間存在大量的直接投射纖維。
並且,不同層的 ACC 神經元與紋狀體神經元形成不同的突觸連接,這主要是由 AMPA/KA 受體介導的。
在來自 ACC 的皮質-紋狀體連接中,KA 受體對基礎突觸傳遞幾乎沒有貢獻。這也提示中樞穀氨酸能突觸是異質的,可能存在至少兩種不同類型的穀氨酸能突觸。
隨後,在紋狀體神經元中,研究人員用 AMPA 受體拮抗劑 GYKI 53655 將 KAR 介導的 EPSC 進行分離。
接下來,該團隊以無鎂人工腦脊液成功誘導了背側紋狀體神經元出現癲癇樣活動。
同時,研究人員還嘗試了另一種模型——戊四唑(PTZ,pentylenetetrazol)誘導的在體癲癇模型。在這項研究中,研究員發現 PTZ 誘發的癲癇發作在 GluK1−/− 小鼠中減弱。
在光纖記錄實驗的進一步研究中,他們發現,ACC 和紋狀體都會在癲癇發作中被激活,而抑制 ACC 到紋狀體的投射可明顯改善癲癇的發作。
同時,其還發現,在 ACC 和紋狀體中,注射選擇性 GluK1 抑製劑 UBP310,也會降低癲癇的易感性和等級,但對癲癇發作的潛伏期沒有太大影響。
此外,抑制 GluK1 受體或來自 ACC 的皮質紋狀體連接的活性可減弱癲癇發作行為。
相關研究結果表明,來自 ACC 的皮質紋狀體投射參與了癲癇發作的調節,並且 KAR-AC1 信號通路是治療癲癇的潛在靶點。
隨後,該課題組深入研究了 AC1 在癲癇病中的作用。結果顯示,AC1 信號通路可延長 PC 階段的潛伏期,降低癲癇發作的死亡率。
此外,研究人員還在小鼠中注射了 AC1 抑製劑 NB001。
結果顯示,與目前的抗癲癇藥物相比,AC1 靶向選擇性抑製劑 NB001 對動物和人類都非常安全。NB001 或許是未來抗癲癇治療的另一種選擇。
未來,該團隊將進一步研究與該通路相關的各種病理情況下的作用。在臨床方面,他們希望能通過進一步將研究成果向市場化推進,並在癲癇病人群體開展相關研究。
參考資料:
1.Li,X. et al. Increased GluK1 Subunit Receptors in Corticostriatal Projection from the Anterior Cingulate Cortex Contributed to Seizure‐Like Activities[J].Advanced Science 2308444(2024). https://onlinelibrary.wiley.com/doi/full/10.1002/advs.202308444
運營/排版:何晨龍