安斯泰來CLDN18.2單抗在美申報上市,創勝集團、奧賽康緊隨其後,誰能拿下同類最優?
出品:新浪財經上市公司研究院
作者:天利
近日,安斯泰來宣佈,美國FDA已接受其靶向Claudin18.2(CLDN18.2)的在研抗體zolbetuximab的生物製品許可申請(BLA),並授予其優先審評資格,用於CLDN18.2陽性局部晚期不可切除或轉移性HER2陰性胃或胃食管結合部(GEJ)腺癌患者的一線治療。
資料來源:安斯泰來官網
資料顯示,Claudins是一個蛋白質家族,其作用是維持控製細胞間分子交換的緊密連接,廣泛分佈於胃、胰腺和肺組織。其中,CLDN18.2亞型是一種特異性亞型,是一種高度選擇性的分子,正常組織中的單複製抗體基本上接觸不到。
而惡性腫瘤的發生會導致緊密連接的破壞,使腫瘤細胞表面的CLDN18.2表位暴露出來。正因如此,CLDN18.2在多種腫瘤(胃癌、肺癌和胰腺癌等)中頻繁異位激活和過表達,這種限制表達使其成為惡性腫瘤免疫治療的理想靶點。
安斯泰來的Zolbetuximab是全球首款CLDN18.2靶向藥物,包括在今年的2023 ASCO GI年會上公佈的臨床III期研究SPOTLIGHT研究在內的多項臨床試驗已初步表明其治療GEJ等癌種的出色潛力,該靶點可成藥性得到初步論證。此外,除了胃癌領域,CLDN18.2靶向治療胰腺癌的研究也已進入Ⅱ期臨床階段。
目前,CLDN18.2已成為國內外藥企攻克胃癌等病種的熱門研發靶點,國內包括創勝集團、奧賽康、科濟藥業在內的一眾藥企也已佈局該靶點。那麼,誰最有希望成為國內“第一個吃螃蟹的人”?各家在研管線有何差異化優勢?本文將基於各管線研發進展及臨床試驗數據進行深入解讀,尋找具備發展潛力的CLDN18.2單抗在研管線。
創勝集團TST001:中低水平表達療效值得期待,研發進展全球第二
從CLDN18.2單抗的研發進展來看,創勝集團的Osemitamab(TST001)的研發進展位列國內第一,全球第二,是繼安斯泰來Zolbetuximab之後第二款公佈II期數據的CLDN18.2單抗。
2023年7月7日,創勝集團宣佈已獲得CDE和韓國食品藥品安全部(MFDS)批準,在HER2陰性、CLDN18.2表達的一線局部晚期或轉移性胃或胃食管(G/GEJ)結合部腺癌患者中,開展Osemitamab聯合納武利尤單抗與化療的TranStar 301全球III期關鍵性臨床試驗,並且正在與歐盟和FDA進行監管互動。
資料來源:創勝集團官網
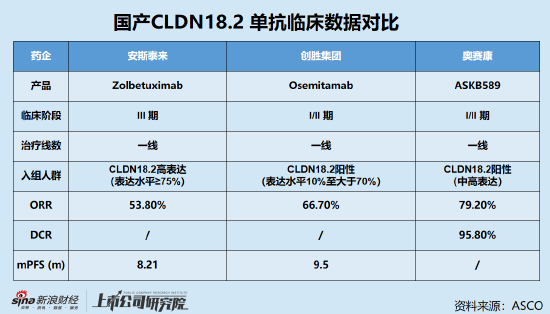
值得關注的是,相比於Zolbetuximab,創勝集團的Osemitamab在臨床試驗中展示出了具有競爭力的差異化優勢。例如,同樣採用CLDN18.2單抗+CAPOX(卡培他濱+奧沙利鉑)的治療方案,安斯泰來Zolbetuximab的III期GLOW研究限定了CLDN18.2高表達(≥75%)的初治G/GEJ腺癌患者,而Osemitamab不僅放寬了對入組患者CLDN18.2表達水平的限制(≥10%),同時也展現出了比Zolbetuximab更佳的療效。
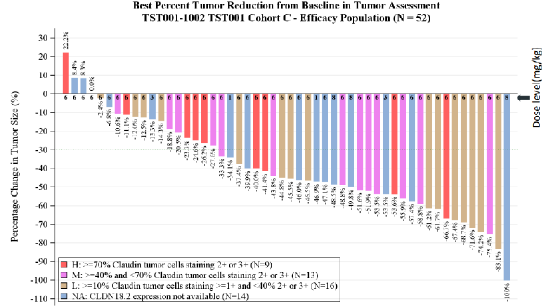
具體而言,Osemitamab+CAPOX化療針對CLDN18.2高表達、中表達、低表達和未知表達(未檢測)患者的部分緩解率(PR)分別為44.4%、69.2%、68.8%和71.4%,在不同CLDN18.2表達水平的患者中均顯示出了不俗的治療效果。
資料來源:2023ASCO
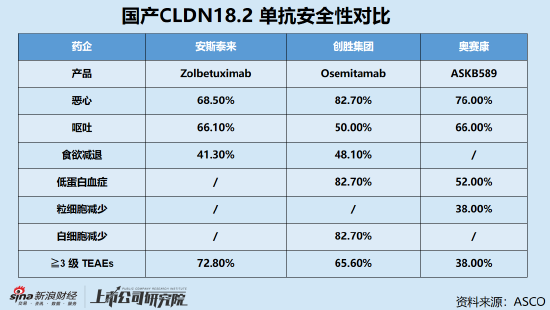
同時,安全性方面,Osemitamab+CAPOX化療方案最常見的TRAEs主要為胃腸道不良事件,包括噁心、嘔吐、食慾減退,以及血液相關不良事件,包括貧血、低白蛋白血症、白細胞減少等,且大多為1-2級。3級不良事件整體發生率為65.6%,低於安斯泰來Zolbetuximab的72.8%。
事實上,作為繼HER2之後胃癌治療的第二個關鍵靶點,目前針對Claudin18.2的檢測方法尚未得到統一,不同研究中所報導的陽性率和高表達率存在一定差異。但率先拔得頭籌的安斯泰來Zolbetuximab與Claudin18.2結合的親和力較低,治療獲益難以覆蓋Claudin18.2低表達人群已是業內人士普遍達成的共識。
而據資料顯示,在所有實體瘤患者群體中,Claudin18.2高表達患者僅占33%—37%。在患者群體規模最大的胃癌領域,高表達患者占比更是僅有20%左右。因此,包括創勝集團Osemitamab在內的國產競品,通過人源化技術、優化表位選擇、抗體結構改造等技術提升Claudin 18.2抗體性能實現“me-better”具有較大希望。
奧賽康ASKB589:中高表達患者ORR達79.2%,療效或為同類最優
相比於安斯泰來的zolbetuximab以及創勝集團的Osemitamab,奧賽康的ASKB589在研發進展上落於下風,目前處於臨床二期。但值得關注的是,ASKB589的客觀緩釋率(cORR)為三者之中最高,同樣具有較大的未來發展潛力。
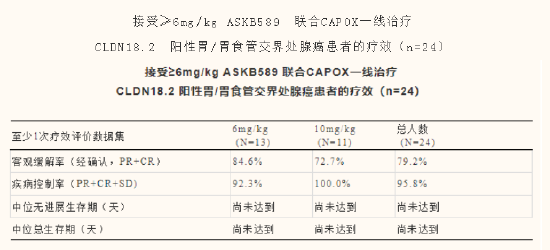
2023年6月16日,奧賽康子公司AskGene在研抗CLDN18.2單抗ASKB589用於實體瘤患者的1/2期多中心試驗最新研究成果在第十五屆國際胃癌大會(IGCC)上以口頭彙報形式公佈。數據顯示,截至2023年4月25日,ASKB589臨床II期擴組研究中,有可測量病灶且至少有過一次治療後腫瘤評估的24例具CLDN18.2中高表達的患者接受了6mg/kg和10mg/kg的ASKB589聯合CAPOX治療,經研究者確認的客觀緩解率(cORR)為79.2%,疾病控製率(DCR)達95.8%。
資料來源:奧賽康官網
目前ASKB589的中位生存期及中位無進展生存期尚未讀出,但從緩釋率來看,ASKB589具有較強的競爭力,在Claudin18.2中高表達患者治療領域內不輸於乃至優於安斯泰來的zolbetuximab。
安全性方面,截至2023年4月25日,ASKB589 I/II期臨床研究共入組106例患者,單藥治療劑量遞增至20mg/kg,聯合化療劑量遞增至15mg/kg,無病人出現劑量限制性毒性反應(DLT),且尚未達到最大耐受劑量(MTD)。擴組研究中,接受6 mg/kg和10 mg/kg ASKB 589聯合CAPOX的治療中均呈現了良好的耐受性,出現的不良事件大多為1-2級以及與化療相關的毒性,3 級不良事件整體發生率僅為38%,低於Zolbetuximab和Osemitamab。